De individuele expressie van testosteronmetabolisme

Robert van Esch MSc.
PsychoNeuroImmunoloog
Hormonen zijn chemische boodschappers die worden geproduceerd en afgegeven in de bloedbaan door specifieke klieren. Eenmaal in de bloedcirculatie oefenen hormonen significante effecten uit op de functie, groei en ontwikkeling van doelcellen en weefsels. De meeste geslachtshormonen worden bij mannen geproduceerd in de testes en bij vrouwen in de ovaria. Kleine hoeveelheden kunnen ook worden geproduceerd door de bijnieren. De wijze waarop iemand spiermassa opbouwt en behoudt, de mate van lichaamsbeharing, de mate waarin de adamsappel zich toont in de keel tot de vorm van de kaaklijn karakteriseren mede het fenotype dat onder de unieke expressie staat van het geslachtshormoon testosteron.
Het lichaam kent drie klassen van geslachtshormonen, namelijk progesteron, oestrogenen en androgenen. Geslachtshormonen zijn de hormonen die cruciaal zijn bij seksuele ontwikkeling en reproductie. Naast de kenmerkende, fysieke manifestaties is testosteron bij volwassen mannen essentieel voor de productie van sperma. Voorts speelt het een rol bij de masculinisatie en de botgezondheid. Terwijl de vrouwelijke menstruele cyclus verloopt op een maandelijkse basis hebben mannen een hormonale cyclus van grofweg 24 uur. Deze piekt vroeg in de ochtend, tussen zes en acht uur, en bereikt ongeveer een halve dag later een dalwaarde. Bovendien heeft de testosteronproductie een omgekeerde verhouding tot die van cortisol, waardoor beide hormooncurves nagenoeg omgekeerd evenredig zijn.
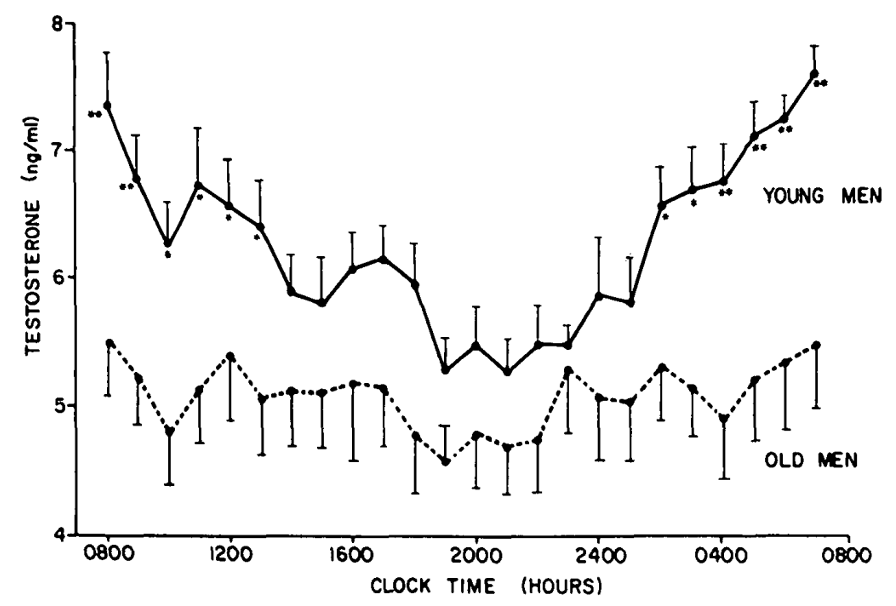
Gemiddelde dagcurve van testosteronspiegels bij gezonde jonge en bij oude mannen
Bremner WJ et al. Journal of Clinical Endocrinology and Metabolism 56(6), 1983
Soms kan de levenscyclus van geslachtshormonen gaan afwijken onder invloed van externe factoren, zoals chronische stress, fysieke overbelasting of slaapgebrek. Hierdoor kan teven de cortisolcurve gaan veranderen als pathofysiologische manifestatie. Zowel genetische programmering als persoonsgebonden, epi-genetische omstandigheden, waaronder voedingspatroon, leefstijl en milieufactoren, hebben impact op de testosteronproductiecapaciteit. Zodoende ontstaat de fysiologische neiging naar een dominantietype.
Polymorfisme
De productie, conversie en transport van testosteron is fysiologisch voor elke man identiek. Toch kent de testosteronhuishouding genetische variaties bij de expressie van die stapsgewijze manifestatie. Een genetische variatie op de oorspronkelijke genetische blauwdruk wordt fenotype genoemd. De genen die coderen voor de betrokken enzymen en eiwitten kunnen afwijkende transcripties tot stand brengen, waardoor functies kunnen veranderen in hun conversie- of bindingscapaciteit. Een afwijkende transcriptie van genetische codes wordt Single Nucleotide Polymorphism (SNP) genoemd. Met betrekking tot de testosteronstofwisseling kan zich bij vijf verschillende stappen een SNP manifesteren, waardoor die stofwisseling persoonsgebonden wordt ofwel een uniek fenotype manifesteert.
Productie en conversie
De synthese van testosteron komt tot stand door de aanwezigheid van het basissubstraat cholesterol, dat wordt omgezet in de precursor pregnenolon. Vervolgens wordt pregnenolon, middels enzymen die onderdeel uitmaken van het cytochroom P-450, geconverteerd naar progesteron en androgenen. Bij die metabole stap kan zich reeds een polymorfisme voordoen, dat de conversiesnelheid en hiermee de productiecapaciteit van testosteron kan beïnvloeden.
Ongeveer tien procent van het testosteron wordt vervolgens omgezet in dihydrotestosteron (DHT), dat biologisch gezien meer potent en actiever is. Dit gebeurt middels het enzym 5α-reductase dat wordt gecodeerd door het gen SRD5A2. Dit gen komt tot expressie gedurende verschillende fasen van de seksuele ontwikkeling en het enzym komt voornamelijk tot uiting in reproductieorganen, lever en huid, bij zowel mannen als vrouwen. Een SNP van de genetische expressie kan zorgen voor verandering van de omvang en snelheid van conversiecapaciteit van het enzym. Dit kan de ratio tussen testosteron en DHT beïnvloeden met gevolgen voor de mate van androgenisatie. De metabole gevolgen van obesitas kunnen eveneens de werkzaamheid van het enzym beïnvloeden, waardoor een sterker androgeen effect kan optreden. Zowel obesitas als een polymorfisme kunnen tevens de ratio tussen testosteron en oestrogenen verstoren. Middels het enzym aromatase, dat behoort tot het cytochroom P-450 en wordt gecodeerd door het gen CYP19A1, kan testosteron worden omgezet in oestrogenen. Een SNP van de genetische expressie kan ook hier de omvang en snelheid van de conversiecapaciteit bepalen, waardoor de ratio tussen testosteron en oestradiol verandert. Dit proces van aromatisatie gebeurt bij zowel mannen als vrouwen en wordt mede bepaald door de functionele status van het enzym en door metabole afwijkingen, zoals overgewicht. Voor een man geldt: hoe groter de omvang en snelheid van omzetting, des te meer androgenisatie afneemt en typisch mannelijke kenmerken vervagen.
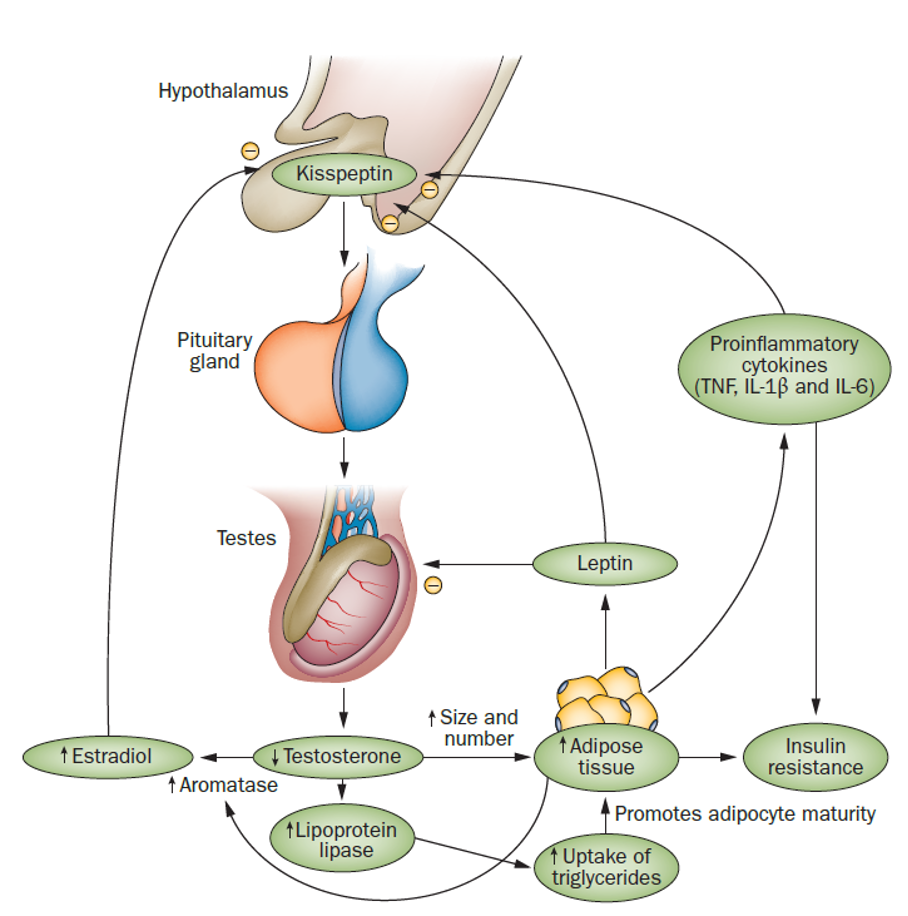
Aromatase-activiteit en de impact van adipositas door overgewicht bij de man
Rao PM et al. Nature Reviews Endocrinology, 9(8), 479–493, 2013
Binding en affiniteit
Testosteron wordt in de bloedbaan gebonden aan transporteiwitten, voornamelijk albumine en sex hormone binding globuline (SHBG), die beide door de lever worden geproduceerd. Slechts een klein deel van de hormonale hoeveelheid circuleert in vrije vorm. De serumwaarde van testosteron heeft aldus een directe correlatie met zowel het volume van SHBG als de bindingscapaciteit aan het eiwit. Het gen dat codeert voor SHBG kent een tweetal SNP met elk een andere, enzymatische bindingscapaciteit.
Wanneer androgenen, zoals ongebonden testosteron en DHT, in contact komen met een celmembraan bepaalt de aanwezigheid en bindingsaffiniteit van de androgeenreceptor óf en hoe sterk de impact van het hormoon zich laat gelden. Ook het gen dat codeert voor androgeenreceptoren kan een polymorfisme hebben, waardoor de androgene expressie wordt beïnvloed. Een receptor met meer bindingsaffiniteit veroorzaakt meer androgenisatie van hiervoor gevoelig weefsel. Indien de receptor relatief vaker door DHT wordt geactiveerd dan door testosteron neemt de androgenisatie verder toe. Zo ontstaan individuele hormoonprofielen met verschillende gradaties van androgene dominantie.
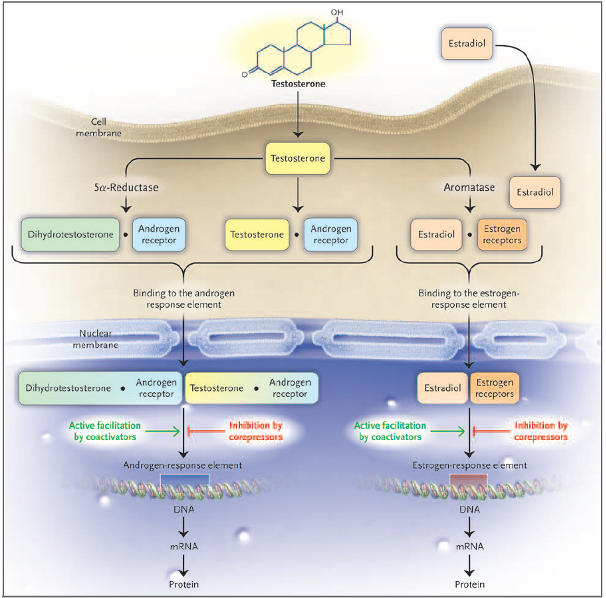
De intracellulaire acties van androgenen
Federman DD. N Engl J Med 354, 2006
Neutralisatie
Androgenen kunnen in werkzaamheid worden geneutraliseerd door enzymen die zich grotendeels bevinden in de lever en behoren tot de fasedetoxificatie van de enterohepatische kringloop. Middels het enzym CYP3A4 kan testosteron worden geconverteerd naar een metaboliet gekoppeld aan een hydroxylgroep (OH), wat feitelijk een vorm van oxidatie is. Hierdoor wordt testosteron sterk verminderd werkzaam. Net als bij DHT vindt vervolgens conjugatie of binding plaats met een molecuul dat de androgenen onwerkzaam maakt. Die conjugatie kan plaatshebben met behulp van enzymen die glucuronidatie of sulfatie tot stand brengen, wat neerkomt op het koppelen van glucuronzuur of zwavel aan het metaboliet. De enzymen die hierbij betrokken zijn, zoals UGT2B17, maken onderdeel uit van de tweede fasedetoxificatie. De genen die coderen voor de enzymen betrokken bij de neutralisatie van geslachtshormonen kunnen een polymorfisme hebben, waardoor betreffende enzymen sneller of langzamer gaan werken. Dientengevolge kan iemand te maken hebben met een kortere of langere halfwaardetijd van een androgeen, zoals bijvoorbeeld DHT. Tevens is de enzymatische functionaliteit afhankelijk van de aanwezigheid van cofactoren in de vorm van micronutriënten, die mede de werkzaamheid bepalen.
Conclusies
Variaties in de expressie van functionele sleutelgenen, betrokken bij het metabolisme van androgenen, kunnen bepalend zijn voor de mate van androgenisatie. De wijze waarop de verschillende genen samenwerken en op elkaar zijn afgestemd bepaalt uiteindelijk de individuele manifestatie bij de productie, circulatie, werkzaamheid en neutralisatie van androgenen. Aldus beschikt elke man over zijn unieke testosteronfactor.
Wetenschappelijk webinar
ReThink Foundation organiseert elke maand een wetenschappelijk webinar waaraan je gratis deel kunt nemen. Hierin reiken wij je de theoretische onderbouwing voor de praktische interventies die je aan je cliënten voorlegt. Het webinar ‘De man en zijn testosteronfactor’ is nu op elk gewenst tijdstip terug te kijken. Onder het kopje ‘opleidingen‘ vind je alle wetenschappelijk webinars en seminars die dit jaar gepland staan of waarvan je de opgenomen versie terug kunt kijken.
Federman DD. The Biology of Human Sex Differences. N Engl J Med 354: 1507-14, 2006
Kicman AT. Pharmacology of anabolic steroids. British journal of pharmacology 154 : 502-521, 2008
Schiffer et al. Intracrine androgen biosynthesis, metabolism and action revisited. Molecular and Cellular Endocrinology 465, 2018
Rao PM et al. Testosterone and insulin resistance in the metabolic syndrome and T2DM in men. Nat. Rev. Endocrinol 2013.
Hooper DR et al. Endocrinological Roles for Testosterone in Resistance Exercise Responses and Adaptations. Sports Medicine 47(9): 1709–1720, 2017
Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: Regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacology & Therapeutics 138: 103–141, 2013
Graupp M et al. Association of genetic variants in the two isoforms of 5α- reductase, SRD5A1 and SRD5A2, in lean patients with polycystic ovary syndrome. Eur. J. Obstet. Gynecol. Reprod. Biol. 157: 175–179, 2011
Beesley J et al. Association Between Single-Nucleotide Polymorphisms in Hormone Metabolism and DNA Repair Genes and Epithelial Ovarian Cancer: Results from Two Australian Studies and an Additional Validation Set. Cancer Epidemiol. Biomarkers Prev. 16: 2557–2565, 2007
Levesque, E et al. Isolation and characterization of UGT2B15(Y85): a UDP glucuronosyltransferase encoded by a polymorphic gene. Pharmacogenetics 7: 317–325, 1997
Zamir A et al. Manipulation of Dietary Intake on Changes in Circulating Testosterone Concentrations. Nutrients 13(3375), 2021


